20.11.2015 r. Laboratorium
Pierwszym tematem kolejnego spotkania NKCH było badanie korozji żelaza przy pomocy tzw. odczynnika ferroksylowego. Jest to zastygnięty, 1% roztwór agaru (przypominający galaretkę), zawierający niewielką ilość heksacyjanożelazianu(III) potasu (odczynnik dający niebieski osad błękitu pruskiego z jonami Fe2+) oraz fenoloftaleiny (czerwony kolor w środowisku zasadowym). Dodatkowo roztwór zawiera pewną ilość chlorku sodu dla przyspieszenia korozji.
Podczas elektrochemicznej korozji żelaza następuje jego utlenienie zgodnie z równaniem:
Fe → Fe2+ + 2e-
Jest to tzw. proces anodowy. Dla zachowania elektroobojętności, procesowi utleniania musi towarzyszyć redukcja (proces katodowy). Może to być redukcja tlenu zawartego w roztworze, bądź redukcja wody. Oba procesy wiążą się z powstawaniem jonów wodorotlenowych. W opisywanym doświadczeniu w miejscach anodowego utleniania powstaje niebieskie zabarwienie, a w miejscach katodowych – czerwone (alkalizacja środowiska i obecność fenoloftaleiny). Zatem wielkość zabarwionego obszaru obrazuje intensywność procesów korozji.
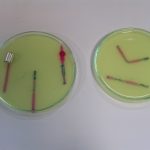
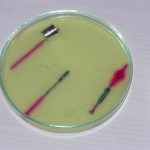
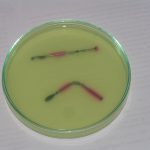
Badanymi próbkami były zwykłe stalowe gwoździe. W pierwszym naczyniu umieszczono gwóźdź owinięty drutem miedzianym, gwóźdź z nałożoną blaszką aluminiową oraz trzeci gwóźdź dla porównania. Obecność metalu mniej aktywnego od żelaza (Cu) przyspiesza korozję. Obecność metalu bardziej aktywnego (Al) opóźnia ten proces, co jest wykorzystywane np. jako cynkowanie galwaniczne (Zn jest bardziej aktywny niż Fe) lub przez stosowanie tzw. protektorów.
W drugim naczyniu umieszczono jeden zwykły gwóźdź i jeden zgięty. Przedmioty poddane naprężeniom mechanicznym wykazują wyższą podatność na korozję.
Zdjęcia wykonano w odstępach kilkuminutowych.
Jak widać, gwóźdź owinięty drutem miedzianym korodował znacznie szybciej niż gwóźdź porównawczy. Z kolej obecność Al praktycznie zahamowała proces korozji żelaza (proces anodowy zachodził na aluminium zamiast na żelazie). W drugim naczyniu gwóźdź zagięty korodował szybciej niż porównawczy. Jest bardzo interesujące, że miejsca katodowe i anodowe są od siebie wyraźnie oddalone.
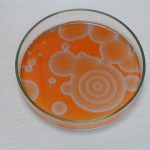
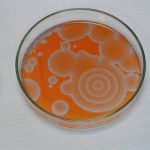
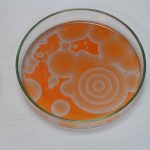
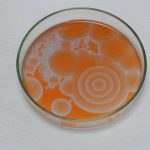
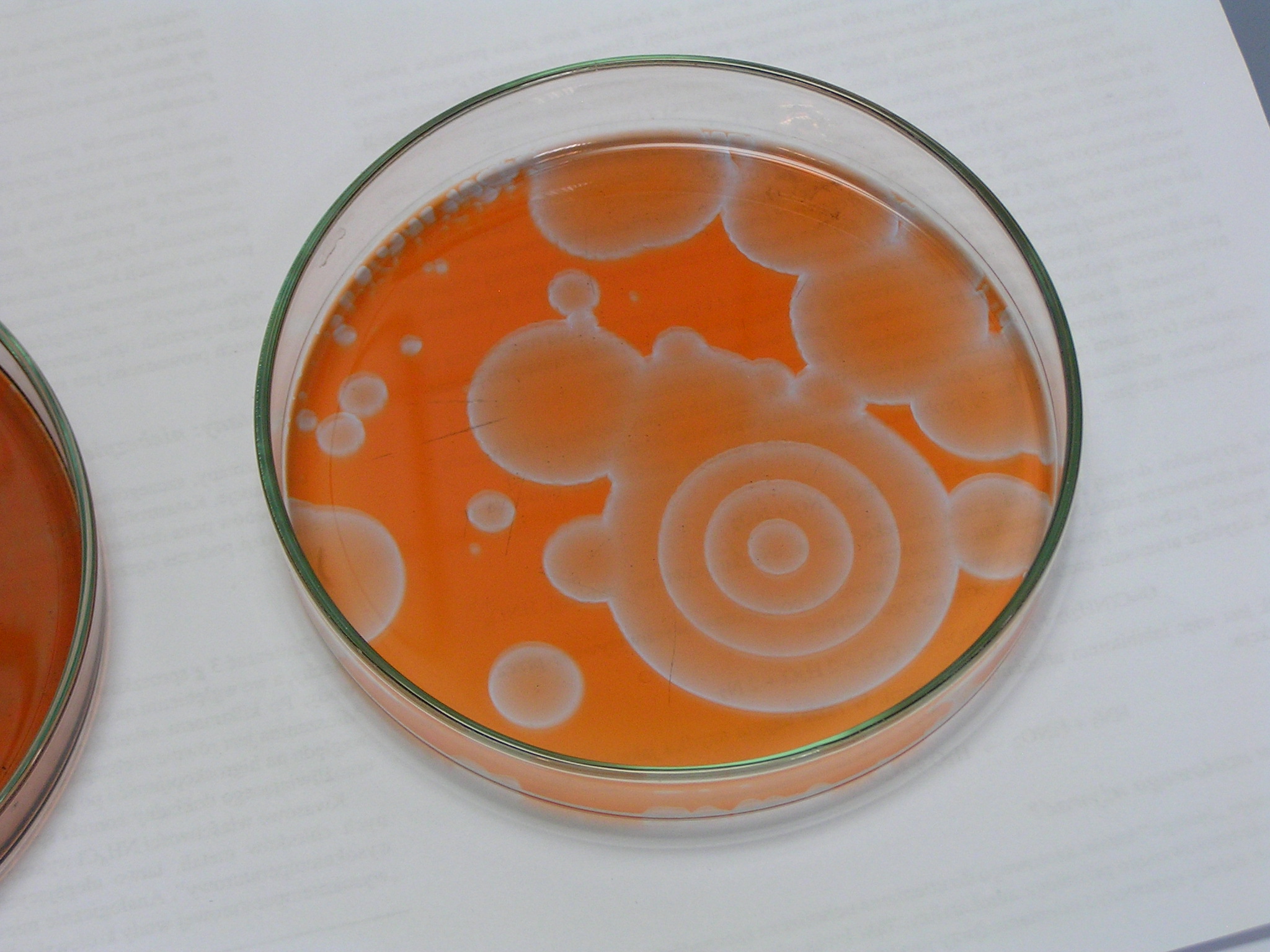
Drugie doświadczenie zatytułowane było „Wędrujące fale reaktywności chemicznej”. W roztworze umieszczonym w szalce Petriego pojawiają się koliste, rozszerzające się kształty, które interferują ze sobą. Jest to bardzo niezwykłe, że z roztworu (który z definicji jest homogeniczny) powstają samorzutnie struktury uporządkowane. Czerwona i niebieska barwa pochodzi od ferroiny – wskaźnika redoks (forma zredukowana – czerwona, utleniona – niebieska). Zdjęcia wykonano w odstępie kilkunastu sekund.
Wykonując powyższe doświadczenia wzorowano się na (genialnej) książce „Doświadczenia Chemiczne” T. Plucińskiego (wyd. Adamantan 1997).